修回日期: 2022-05-26
接受日期: 2022-06-21
在线出版日期: 2022-07-28
长链非编码RNA(long non-coding RNA, lncRNA)在基因表达过程中发挥着关键调控作用, 与铁死亡过程存在着密切关系. 目前肝细胞癌(hepatocellular carcinoma, HCC)中基于铁死亡相关lncRNA作为生物标志物研究鲜见.
探讨铁死亡相关lncRNA与HCC之间的相关性, 并构建HCC生存预后预测模型, 为其个体化治疗和免疫研究提供依据.
利用癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库下载HCC转录组数据与临床信息, 利用FerrDb数据库下载铁死亡基因, 通过共表达方法筛选出铁死亡相关lncRNA, 利用R软件对铁死亡基因和其相关lncRNA进行差异分析. 利用Cox回归分析筛选出与HCC预后相关的铁死亡相关lncRNA, 构建HCC患者生存预后预测模型. 计算TCGA数据库中各HCC样本的预测模型风险值, 根据风险值中位数分为高低风险组. 利用生存分析、单、多因素独立预后分析和ROC曲线, 验证预测模型的准确性和实用性. 利用ssGSEA富集分析评估高、低风险组中免疫反应情况.
筛选共获得147个铁死亡相关lncRNA, 单、多因素Cox回归分析分别获得49个和11个与HCC生存预后相关的铁死亡相关lncRNA. 生存分析结果显示, 高风险组生存率显著低于低风险组(P<0.001). 独立预后分析结果表明, 模型风险评分是预测HCC患者预后的独立风险因素. 免疫功能分析结果提示, 高风险组中免疫细胞溶解活性和Ⅱ型干扰素应答呈抑制状态, 而高风险组中MHC Ⅱ类分子途径呈高反应状态.
本研究在HCC患者中构建了基于铁死亡相关lncRNA预测模型, 为临床评估HCC患者预后提供了理论依据, 并为铁死亡水平相关靶向治疗提供了一定参考.
核心提要: 长链非编码RNA(long non-coding RNA, lncRNA)在基因表达过程中发挥着关键调控作用, 与铁死亡过程存在着密切关系. 本研究通过生物信息学方法证实铁死亡相关lncRNA模型风险评分是预测HCC患者预后的独立风险因素.
引文著录: 王海明, 何基安, 王建华. 基于铁死亡相关lncRNA构建肝细胞癌预后模型. 世界华人消化杂志 2022; 30(14): 623-630
Revised: May 26, 2022
Accepted: June 21, 2022
Published online: July 28, 2022
Long non-coding RNAs (lncRNAs) play a key regulatory role in modulating gene expression and are closely related to iron death. At present, biomarkers for hepatocellular carcinoma (HCC) based on iron death-related lncRNAs are rarely studied.
To explore the prognostic significance of ferroptosis-related lncRNAs in HCC, and to develop a survival prognosis prediction model for HCC to provide a basis for its individualized treatment and immune research.
HCC transcriptome data and clinical information were obtained from The Cancer Genome Atlas (TCGA) database, and ferroptosis-related genes were obtained from the FerrDb database. Ferroptosis-related lncRNAs were screened by co-expression method, and R software was used to perform differential analysis of ferroptosis genes and their related lncRNAs. Cox regression analysis was used to screen out ferroptosis-related lncRNAs related to the prognosis of HCC, and to construct a prediction model of survival and prognosis for HCC patients. Survival analysis, univariate and multivariate independent prognostic analyses, and ROC curve analysis were performed to verify the accuracy and practicability of the prediction model. ssGSEA enrichment analysis was performed to evaluate the immune response in high and low risk groups.
A total of 147 ferroptosis-related lncRNAs were obtained. Survival analysis showed that the survival rate of the high-risk group was significantly lower than that of the low-risk group (P < 0.001). Independent prognostic analysis showed that the model risk score was an independent risk factor predicting the prognosis of HCC patients. Immune function analysis showed that the immune cell lysis activity and type Ⅱ interferon response were suppressed in the high-risk group, while the MHC class Ⅱ molecular pathway was highly reactive in the high-risk group.
A prediction model based on ferroptosis-related lncRNA has been constructed for HCC patients, which provides a theoretical basis for clinical evaluation of the prognosis of HCC patients, and for targeted therapy related to ferroptosis levels.
- Citation: Wang HM, He JA, Wang JH. Development of a prognostic model for hepatocellular carcinoma based on ferroptosis-related long non-coding RNAs. Shijie Huaren Xiaohua Zazhi 2022; 30(14): 623-630
- URL: https://www.wjgnet.com/1009-3079/full/v30/i14/623.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i14.623
肝细胞癌(hepatocellular carcinoma, HCC)是起源于肝脏上皮组织的恶性肿瘤, 约占原发性肝癌的75%-85%, 具有高致死率和高转移复发率的特性[1]. HCC为高度异质性肿瘤, 具有高度侵袭性、表型耐药和代谢紊乱等生物学特征, 多层次制约了总体临床治疗效果[2,3]. 因此, 迫切需要探究HCC发生发展机制、新治疗策略和潜在生存预后预测模型, 以指导临床个体化治疗方案的制订.
铁死亡是近年来发现的一类新型铁离子依赖性调节性细胞死亡模式, 其主要是通过铁离子的积累、自由基的产生、脂肪酸供应与脂质过氧化物增加等途径诱导细胞死亡[4]. 目前研究表明[5], 铁死亡在HCC的发生发展过程中发挥着重要调控作用, 铁死亡基因靶向治疗有可能成为治疗HCC的新手段. 长链非编码RNA(long non-coding RNA, lncRNA)在基因表达过程中发挥着关键调控作用, 与铁死亡过程存在着密切关系[6]. 目前HCC中基于铁死亡基因作为生物标志物研究鲜见, 本研究旨在通过探究铁死亡相关lncRNA与HCC患者预后之间的关系, 构建生存预后预测模型, 为其个体化治疗和免疫研究提供依据.
通过癌症基因组图谱(TCGA, https://portal.gdc.cancer.gov)数据库下载HCC患者正常样本和肿瘤样本转录组数据及其临床相关信息, 资料截止至2021-10-29. 转录组数据共得到HCC肿瘤样本374例, 正常样本50例; 临床相关样本共370例, 其中临床信息完整样本350例. 转录组数据通过Perl软件注释并区分为mRNA和lncRNA. 铁死亡基因表达数据与mRNA取交集获取, 其中铁死亡基因通过铁死亡数据库(Ferrdb)获取. 通过共表达分析方法获得与铁死亡基因密切相关的lncRNA(r>0.5, P<0.05).
1.2.1 HCC预后相关铁死亡相关lncRNA筛选: 利用R软件(4.1.2版)对共表达分析方法获得的铁死亡相关lncRNA进行差异分析. 具体筛选标准设定为|logFC|>1, P<0.05. 差异铁死亡相关lncRNA与临床相关信息中生存时间和生存状态合并, 利用"survival"包对合并数据进行单因素Cox回归分析(P<0.05), 获得各个差异铁死亡相关lncRNA风险值(hazard ratio, HR). 单因素Cox回归分析获得lncRNA进一步行多因素Cox分析, 获得HCC各样本风险评分和影响HCC患者的关键铁死亡相关lncRNA.
1.2.2 构建HCC预后风险评分模型: 根据单、多因素Cox回归分析筛选获得的铁死亡相关lncRNA, 构建基于铁死亡相关lncRNA预后风险评分模型. 模型公式: 风险评分 = ∑ni=1coefi*Xi, 利用该模型公式计算出各个样本相应的风险评分, 取其中位值作为截断值, 将HCC患者分为高低风险两组. 模型公式中n代表铁死亡相关lncRNA数, coefi代表相应lncRNA多因素分析获得的回归系数, Xi代表相应lncRNA表达量.
1.2.3 预后风险评分模型验证: 本研究利用三种方式对基于铁死亡相关lncRNA预后风险评分模型进行验证. 利用R软件"survival"和"survminer"包对高低风险组进行Kaplan-Meier生存分析, 并绘制相关生存曲线. 单多因素Cox回归分析, 验证风险评分能否作为评估HCC患者生存预后的独立风险因子. 利用R软件"timeROC"包验证风险评分模型的特异性和灵敏度, 并绘制受试者工作特征曲线(receiver operator characteristic curve, ROC).
1.2.4 免疫功能分析: 整合预后风险评分模型中11个铁死亡相关lncRNA的表达量及相应样本风险评分. 利用ssGSEA富集分析评估高低风险组中免疫反应情况.
统计学处理 采用t检验分析铁死亡相关lncRNA在正常样本和肿瘤样本中的表达差异. 共表达分析采用皮尔逊相关系数(Pearson correlation coefficient)法. 生存曲线通过Kaplan-Meier方法绘制, 运用对数秩检验(Log-rank test)进行分析.
TCGA数据库下载得到HCC肿瘤样本(374例)和正常样本(50例)的转录组数据和临床相关信息. Ferrdb数据库下载得到铁死亡基因259个, 并提取铁死亡基因表达量. 按照FDR<0.05且logFC>1标准分析, 筛选得到差异表达铁死亡基因共84个, 表达上调及下调基因数目分别为71个和13个. 按照r>0.5且P0.05筛选标准, 共表达分析得到铁死亡相关lncRNA共233个, 其中呈差异表达的lncRNA共147个.
HCC中呈差异表达铁死亡相关lncRNA, 与生存时间和生存状态合并后, 纳入单因素Cox回归分析. 筛选条件设置为P<0.05, 统计分析发现49个lncRNA与生存预后显著相关. 多因素Cox回归将单因素Cox回归分析结果再次进行筛选, 共得到11个lncRNA. 结果如表1所示.
| 基因 | 系数(coef) | HR | 95%CI | P值 | |
| 下限 | 上限 | ||||
| LINC01224 | 0.569 | 1.767 | 1.223 | 2.553 | 2.42E-3 |
| SREBF2-AS1 | 0.430 | 1.537 | 1.149 | 2.055 | 3.76E-3 |
| NRAV | 0.153 | 1.165 | 1.008 | 1.346 | 3.81E-2 |
| KDM4A-AS1 | 0.654 | 1.923 | 1.071 | 3.452 | 2.86E-2 |
| ZFPM2-AS1 | 0.043 | 1.044 | 0.993 | 1.097 | 9.17E-2 |
| SNHG20 | -0.287 | 0.751 | 0.554 | 1.018 | 6.54E-2 |
| SNHG4 | 0.232 | 1.261 | 0.954 | 1.667 | 0.103 |
| MKLN1-AS | 0.982 | 2.671 | 1.602 | 4.454 | 1.66E-4 |
| PTOV1-AS1 | -0.502 | 0.605 | 0.423 | 0.866 | 6.03E-3 |
| LINC00942 | 0.023 | 1.023 | 1.003 | 1.044 | 2.76E-2 |
| ZNF232-AS1 | 0.066 | 1.068 | 0.986 | 1.157 | 0.108 |
根据多因素Cox回归分析筛选得到lncRNA构建预后风险评分模型. 风险评分计算方法为11个lncRNA表达水平与风险系数的乘积. 具体风险评分模型为: 风险评分 = LINC01224*0.569+SREBF2-AS1*0.430+NRAV*0.153+KDM4A-AS1*0.654+ZFPM2-AS1*0.043+SNHG20*(-0.287)+SNHG4*0.232+MKLN1-AS*0.982+PTOV1-AS1*(-0.502)+LINC00942*0.023+ZNF232-AS1*0.066.
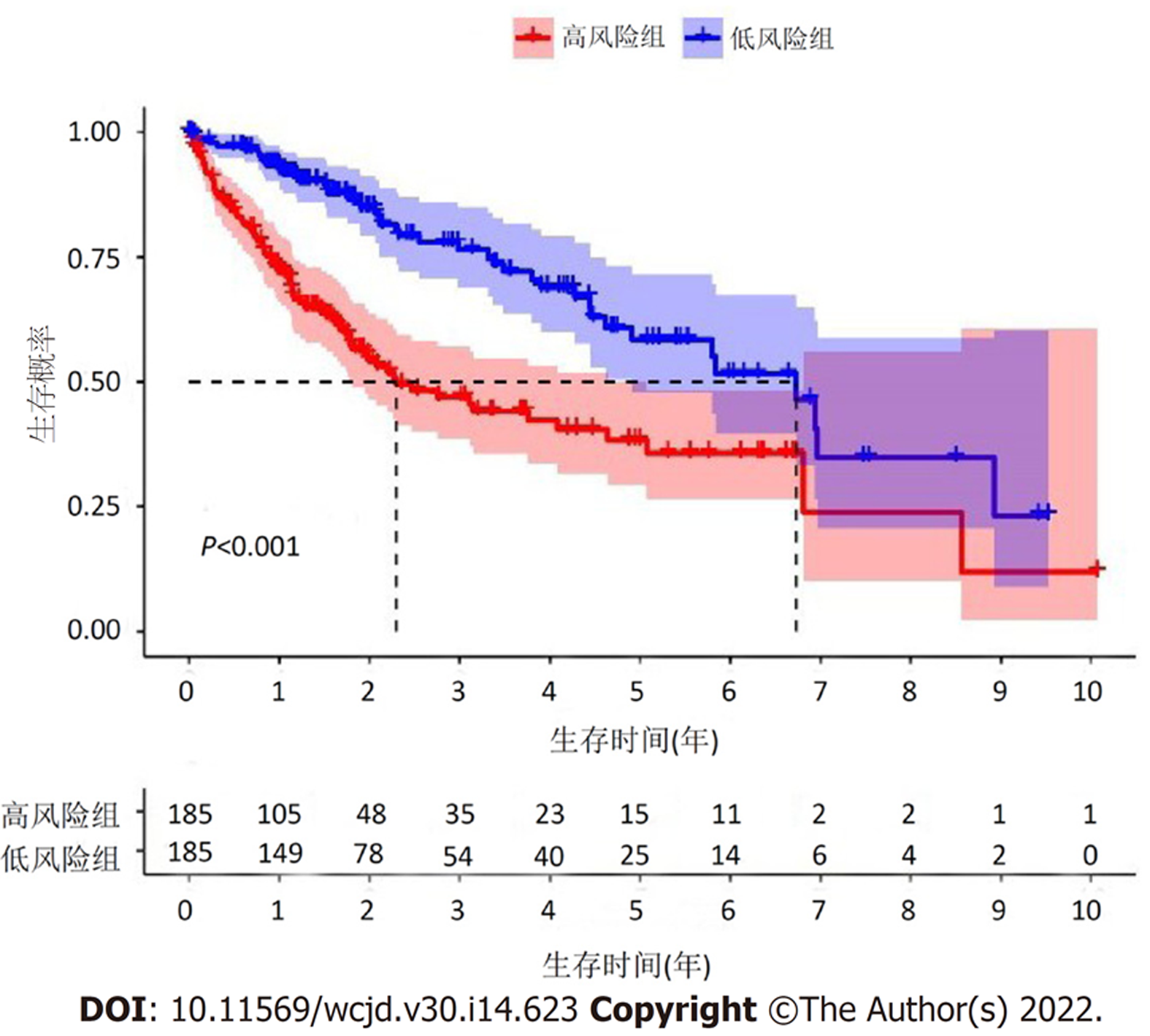
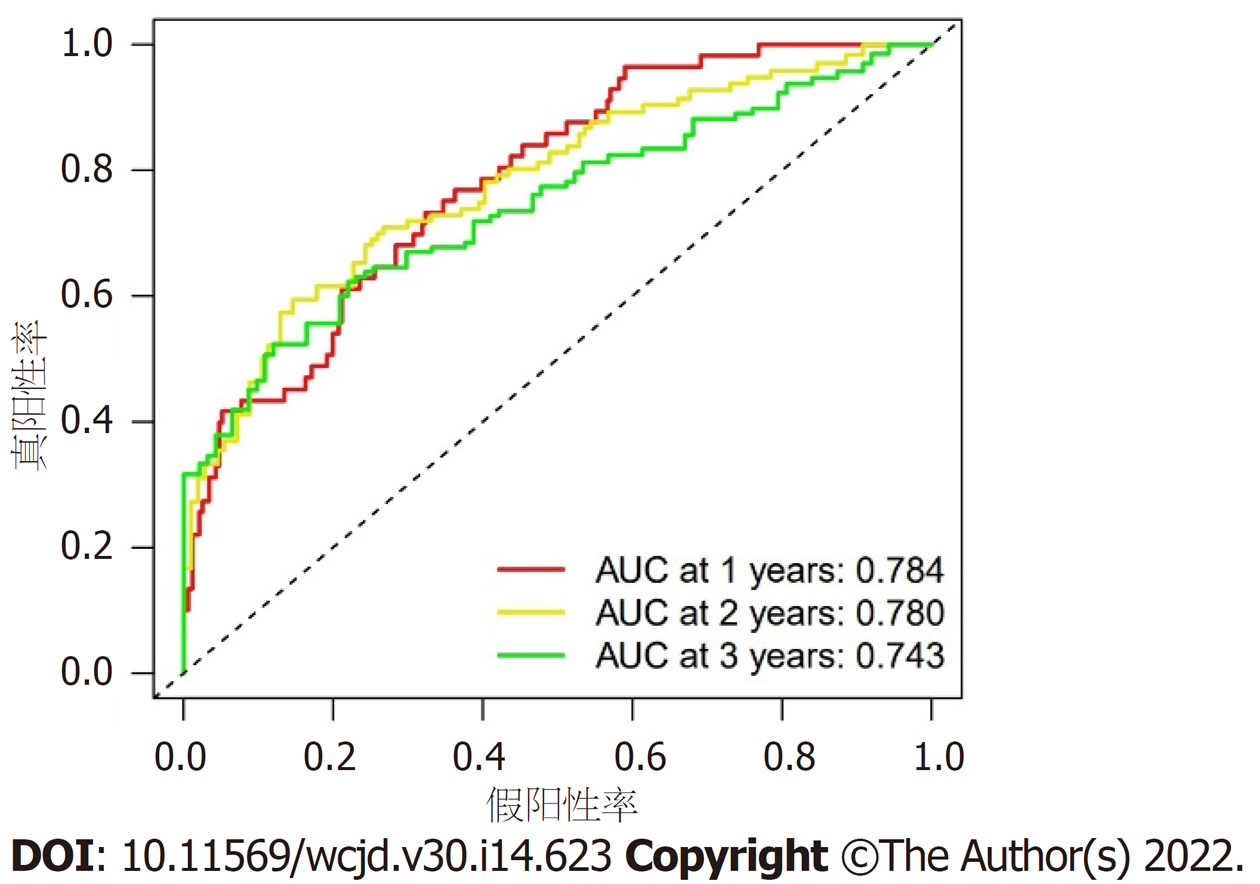
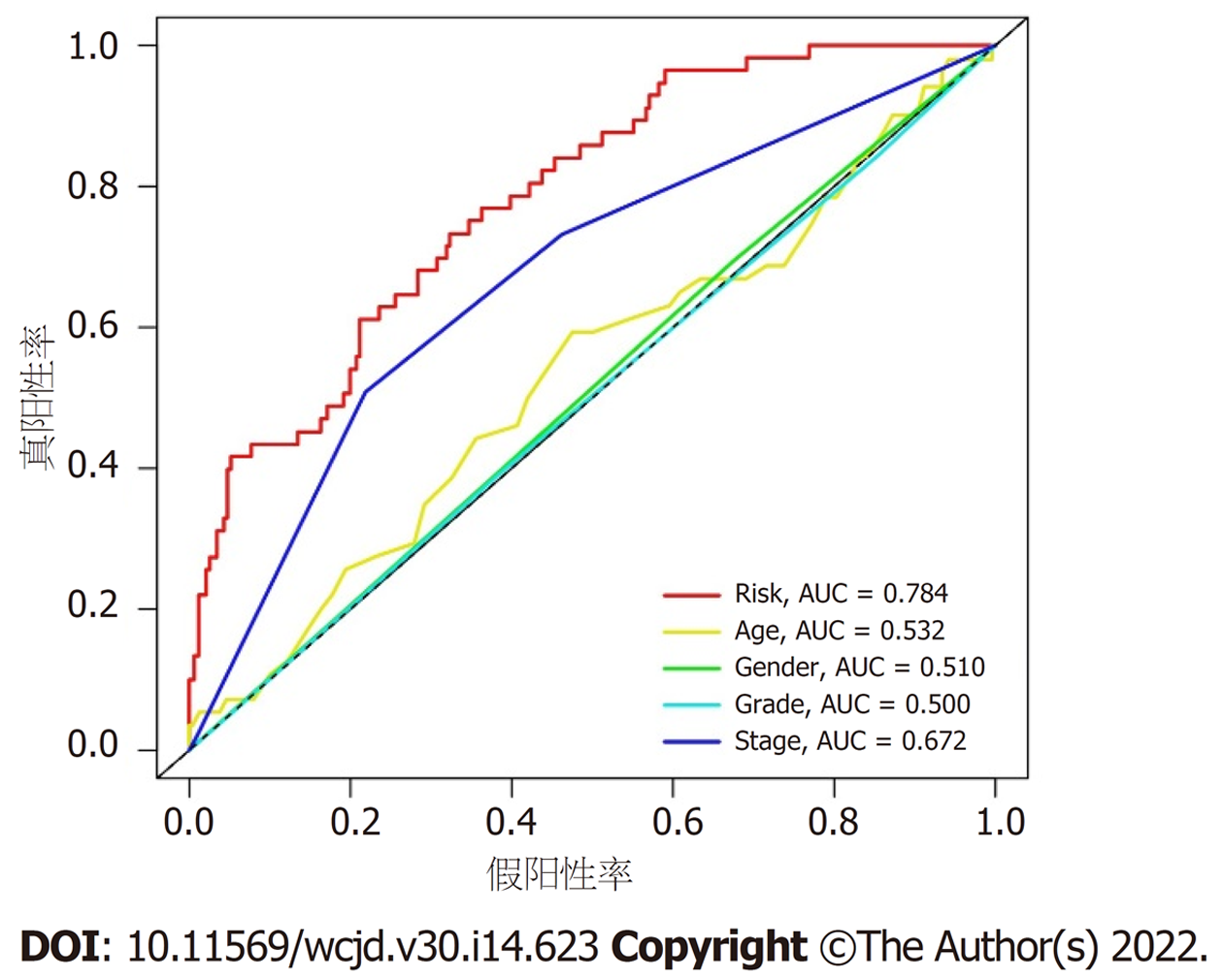
根据预后风险评分模型, 计算各个样本的风险值. 风险值中位数(0.852)作为截断值, 根据截断值将370例HCC样本分为高、低风险组, 每组各185例. Kaplan-Meier生存分析结果显示, 高、低风险组平均生存时间分别为(1.76±1.85)年和(2.50±2.04)年, 两组生存时间存在显著差异(P<0.001), 见图1. Cox回归分析评价预后风险评分模型对HCC生存状态的影响. 单因素Cox回归分析结果显示, 风险评分模型与生存时间和生存状态显著相关[风险比(hazard ratio, HR) = 1.211; 95%置信区间(confidence interval, CI) = (1.159-1.266); P<0.001]. 进一步行多因素Cox回归分析结果显示, 预后风险评分模型是预测生存情况的独立危险因子(HR = 1.190; 95%CI = 1.135-1.247; P<0.001), 见表2. ROC分析结果显示, 风险评分模型预测HCC患者1年、2年和3年生存率的ROC曲线下面积(area under curve, AUC)分别为0.784、0.780和0.743, 如图2. ROC曲线进一步分析, 临床特征与风险评分模型对HCC患者生存率的影响, 结果提示风险评分模型和TNM分期对HCC患者生存具有显著影响, AUC值分别为0.784和0.672, 风险评分模型优于TNM分期, 如图3.
| 变量 | 单因素分析 | 多因素分析 | ||
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| 年龄 | 1.010(0.995-1.025) | 0.181 | 1.008(0.993-1.023) | 0.313 |
| 性别 | 0.824(0.560-1.214) | 0.328 | 0.838(0.557-1.262) | 0.398 |
| 组织分级 | 1.124(0.871-1.450) | 0.368 | 1.091(0.832-1.431) | 0.531 |
| TNM分期 | 1.674(1.361-2.059) | 1.044E-6a | 1.573(1.269-1.951) | 3.649E-5a |
| 风险评分 | 1.211(1.159-1.266) | 1.931E-17a | 1.190(1.135-1.247) | 4.340E-13a |
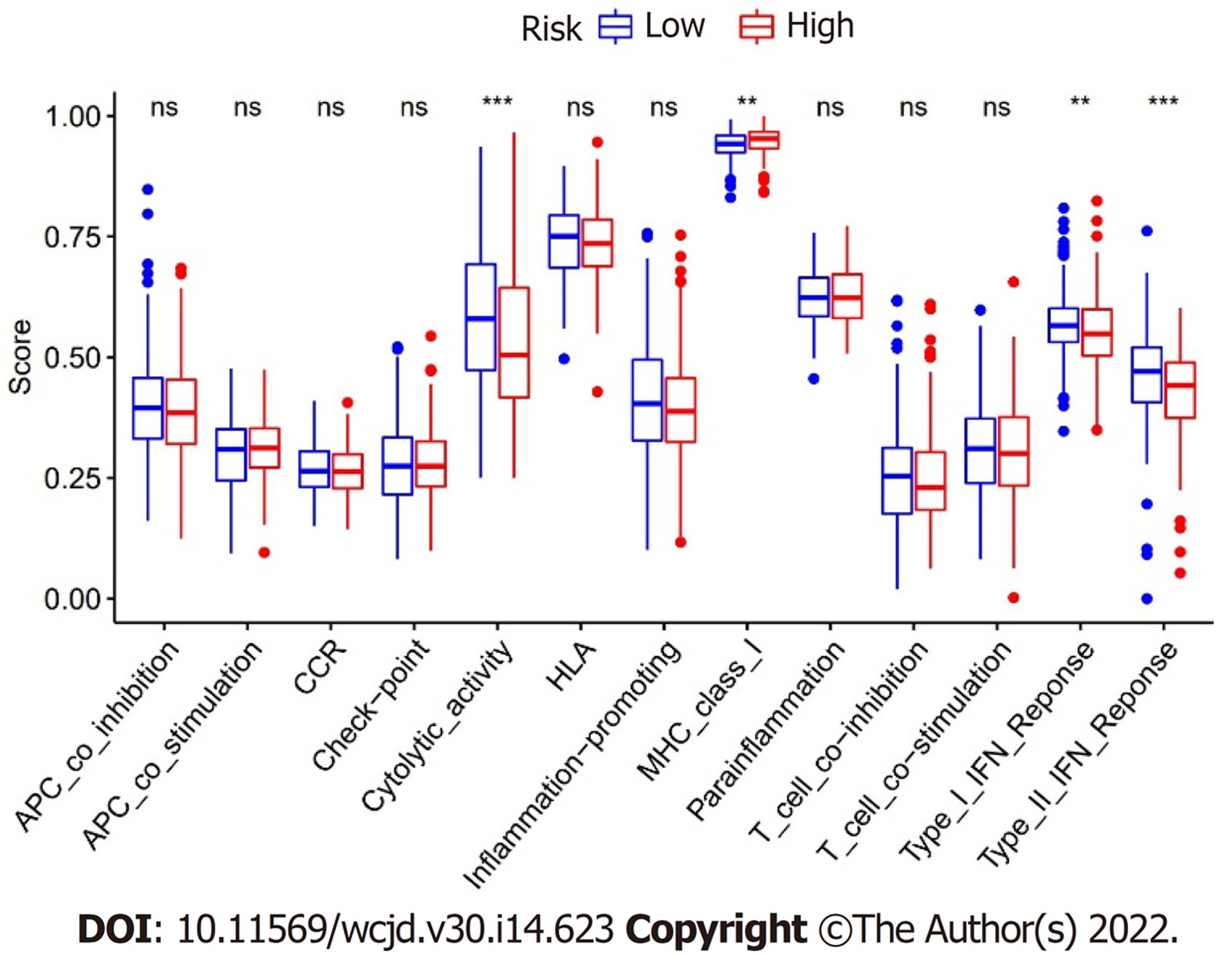
高低风险组ssGSEA富集分析结果显示, 高风险组中免疫细胞溶解活性和Ⅱ型干扰素应答呈抑制状态, 而高风险组中MHC Ⅱ类分子途径呈高反应状态, 均具有统计学差异(P<0.05), 如图4.
HCC是我国常见的恶性肿瘤, 目前其发生和发展的具体分子机制尚不明确. 近年来研究发现, 铁死亡基因和lncRNA在多种恶性肿瘤的发生发展过程中发挥着重要调控作用, 如胶质母细胞瘤[7]、肺癌[8]、卵巢癌[9]和胰腺导管腺癌[6]等, 并构建了相关模型预测预后. 然而, 铁死亡相关lncRNA在HCC分子层面中的机制尚不明确, 同时预测模型构建方面研究较少.
铁死亡在HCC发生和发展过程中发挥着重要调控作用. 目前研究已证实, 胱氨酸-谷氨酸反向转运体(system XC)和GPX4可以调控铁死亡. Tang等研究表明, 索拉菲尼是常见的铁死亡诱导剂, 其可以通过抑制system XC系统和影响GSH, 诱导肝癌细胞发生铁死亡[10]. 肿瘤抑制基因p53亦可以通过调控铁死亡, 影响HCC的发展. Chen等[11]研究提示, p53可以通过调控SLC7A11转录, 影响system XC系统活性, 诱发肝癌细胞铁死亡. 此外, miRNA-214、BRCA1相关蛋白1等分子均可影响肝癌细胞铁死亡[12].
本研究通过利用生物信息学技术, 分析了233个铁死亡相关lncRNA. 最终得到11个铁死亡相关lncRNA, 并成功构建了HCC生存预后预测模型. 我们得出, 高风险组总体生存率显著低于低风险组(P<0.001). 预测HCC患者1年、2年及3年生存率的ROC曲线下面积均大于0.7, 提示该模型具有较好的特异性和敏感性. 我们进一步通过检索文献发现, 11个预后lncRNA均与肿瘤的发生发展关系密切. Sun等[13]研究显示, LINC01224通过调控MiR-193a-5p/CDK8轴影响胃癌细胞凋亡和肿瘤进展. Chen等[14]通过将KDM4A-AS1过表达肝癌细胞株Hep3B移植到裸鼠皮下, 发现过表达组肿瘤组织内Ki-67、N-钙粘蛋白和波形蛋白表达水平较敲减组明显升高, 肿瘤负荷明显增大. 进一步研究发现, KDM4A-AS1通过调控KPNA2/HIF-1α信号通路, 促进肝癌的发生和发展. 提示KDM4A-AS1在HCC发挥促癌作用. Ren等研究发现[15], 甲状腺癌组织中ZFPM2-AS1较癌旁组织显著升高; 同时体外实验研究提示, ZFPM2-AS1过表达可以促进甲状腺癌细胞株SW579增殖和侵袭. Xing等[16]通过分析30对卵巢癌组织, 发现SNHG20在卵巢癌组织中呈过表达状态; SNHG20过表达促进SKOV3和A2780细胞株增殖和侵袭. 以上研究均提示, 铁死亡相关lncRNA在恶性肿瘤的进展过程中发挥着重要调控作用. 然而, 铁死亡相关lncRNA目前在HCC中的研究罕见, 其影响HCC发生及发展的分子机制和其在HCC临床实践中的指导作用有待进一步探究.
近年来研究表明, 铁死亡在恶性肿瘤免疫调控过程中发挥着重要作用. 铁死亡在T细胞、B细胞、粒细胞及单核巨噬细胞等免疫细胞调控中发挥着重要调控作用[17]. Wang等在肿瘤小鼠模型中研究发现, CD8+ T细胞通过分泌干扰素γ诱导肿瘤细胞中SLC3A2 和SLC7A11的表达, 从而降低肿瘤细胞对胱氨酸的摄取, 致使肿瘤细胞发生铁死亡[18]. Muri Jonathan等实验表明, 敲除B1细胞和边缘区B细胞中铁死亡关键调控基因GPX4, 可以诱导细胞铁死亡, 从而影响B细胞的免疫应答[19]. 本研究分析提示, 铁死亡相关lncRNA可以通过调控免疫细胞溶解活性、Ⅱ型干扰素应答及MHC Ⅱ类分子途径影响HCC免疫状态, 从而影响HCC患者预后.
综上, 本研究筛选得到11个与HCC患者预后关系密切的铁死亡相关lncRNA, 其构成的预后风险评分模型对HCC患者预后具有较好的预测价值. 同时与其它临床指标相结合, 可能为制定个体化治疗方案或随访方案提供更多的理论依据. 本课题组下一步拟设计分子实验, 验证铁死亡相关lncRNA在HCC发生、发展中的确切分子机制.
肝细胞癌是我国高发恶性肿瘤之一, 70%-80%首诊时已是晚期, 居我国恶性肿瘤相关死亡原因第三位. 尽管近年来, 外科手术治疗、介入治疗、化学药物治疗等传统方法和靶向、免疫治疗等创新疗法均取得了显著进步, 但是肝细胞癌患者总体生存期仍待进一步提升. 因此,探究肝细胞癌发生发展机制、新治疗策略和潜在生存预后预测模型, 来指导临床个体化治疗显得十分迫切.
铁死亡是一种铁依赖性的、非细胞凋亡性的新型细胞死亡方式. 研究表明, 铁死亡基因及其相关lncRNA可以调控多种恶性肿瘤的发生发展过程, 如胶质母细胞瘤、肺癌、卵巢癌和胰腺导管腺癌等, 并初步构建了相关模型预测预后. 然而, 铁死亡相关lncRN肝细胞癌分子层面中的机制尚不明确, 同时预测模型构建方面研究较少.
本研究通过生物信息学方法, 探究铁死亡相关lncRNA与肝细胞癌患者预后之间的关系, 并构建生存预后预测模型, 为其个体化治疗和免疫研究提供依据.
检索癌症基因组图谱数据库, 获取肝细胞癌患者正常样本和肿瘤样本转录组数据及其临床相关信息. 采用共表达分析方法获得与铁死亡基因密切相关lncRNA. 采用单、多因素Cox回归分析方法获取与肝细胞癌患者预后密切相关铁死亡相关lncRNA, 构建基于铁死亡相关lncRNA预后风险评分模型, 并进行验证.
分析癌症基因组图谱数据库下载数据, 筛选共获得147个铁死亡相关lncRNA. 单、多因素Cox回归分析分别获得49个和11个与HCC生存预后相关的铁死亡相关lncRNA. 生存分析结果显示, 高风险组生存率显著低于低风险组(P<0.001). 独立预后分析结果表明, 模型风险评分是预测HCC患者预后的独立风险因素. 免疫功能分析结果提示, 高风险组中免疫细胞溶解活性和Ⅱ型干扰素应答呈抑制状态, 而高风险组中MHC Ⅱ类分子途径呈高反应状态.
铁死亡相关lncRNA模型风险评分是预测肝细胞癌患者预后的独立风险因素. 机制可能时通过调控免疫细胞溶解活性、Ⅱ型干扰素应答及MHC Ⅱ类分子途径发挥调控作用.
铁死亡相关lncRNA模型有望成为临床评估肝细胞癌患者预后的评分工具之一, 同时该模型中相关lncRNA可能成为肝细胞癌靶向或免疫治疗的潜在靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Rodriguez S, Skeet K, Mehmetoglu-Gurbuz T, Goldfarb M, Karri S, Rocha J, Shahinian M, Yazadi A, Poudel S, Subramani R. Phytochemicals as an Alternative or Integrative Option, in Conjunction with Conventional Treatments for Hepatocellular Carcinoma. Cancers (Basel). 2021;13. [PubMed] [DOI] |
| 2. | Myojin Y, Kodama T, Maesaka K, Motooka D, Sato Y, Tanaka S, Abe Y, Ohkawa K, Mita E, Hayashi Y, Hikita H, Sakamori R, Tatsumi T, Taguchi A, Eguchi H, Takehara T. ST6GAL1 Is a Novel Serum Biomarker for Lenvatinib-Susceptible FGF19-Driven Hepatocellular Carcinoma. Clin Cancer Res. 2021;27:1150-1161. [PubMed] [DOI] |
| 3. | Arechederra M, Bazai SK, Abdouni A, Sequera C, Mead TJ, Richelme S, Daian F, Audebert S, Dono R, Lozano A, Gregoire D, Hibner U, Allende DS, Apte SS, Maina F. ADAMTSL5 is an epigenetically activated gene underlying tumorigenesis and drug resistance in hepatocellular carcinoma. J Hepatol. 2021;74:893-906. [PubMed] [DOI] |
| 4. | Chen X, Yu C, Kang R, Kroemer G, Tang D. Cellular degradation systems in ferroptosis. Cell Death Differ. 2021;28:1135-1148. [PubMed] [DOI] |
| 5. | Gao R, Kalathur RKR, Coto-Llerena M, Ercan C, Buechel D, Shuang S, Piscuoglio S, Dill MT, Camargo FD, Christofori G, Tang F. YAP/TAZ and ATF4 drive resistance to Sorafenib in hepatocellular carcinoma by preventing ferroptosis. EMBO Mol Med. 2021;13:e14351. [PubMed] [DOI] |
| 6. | Tang R, Wu Z, Rong Z, Xu J, Wang W, Zhang B, Yu X, Shi S. Ferroptosis-related lncRNA pairs to predict the clinical outcome and molecular characteristics of pancreatic ductal adenocarcinoma. Brief Bioinform. 2022;23. [PubMed] [DOI] |
| 7. | Chen Q, Wang W, Wu Z, Chen S, Chen X, Zhuang S, Song G, Lv Y, Lin Y. Over-expression of lncRNA TMEM161B-AS1 promotes the malignant biological behavior of glioma cells and the resistance to temozolomide via up-regulating the expression of multiple ferroptosis-related genes by sponging hsa-miR-27a-3p. Cell Death Discov. 2021;7:311. [PubMed] [DOI] |
| 8. | Yao J, Chen X, Liu X, Li R, Zhou X, Qu Y. Characterization of a ferroptosis and iron-metabolism related lncRNA signature in lung adenocarcinoma. Cancer Cell Int. 2021;21:340. [PubMed] [DOI] |
| 9. | Peng J, Hao Y, Rao B, Zhang Z. A ferroptosis-related lncRNA signature predicts prognosis in ovarian cancer patients. Transl Cancer Res. 2021;10:4802-4816. [PubMed] [DOI] |
| 10. | Tang H, Chen D, Li C, Zheng C, Wu X, Zhang Y, Song Q, Fei W. Dual GSH-exhausting sorafenib loaded manganese-silica nanodrugs for inducing the ferroptosis of hepatocellular carcinoma cells. Int J Pharm. 2019;572:118782. [PubMed] [DOI] |
| 11. | Chen X, Kang R, Kroemer G, Tang D. Broadening horizons: the role of ferroptosis in cancer. Nat Rev Clin Oncol. 2021;18:280-296. [PubMed] [DOI] |
| 12. | Zhang Y, Shi J, Liu X, Feng L, Gong Z, Koppula P, Sirohi K, Li X, Wei Y, Lee H, Zhuang L, Chen G, Xiao ZD, Hung MC, Chen J, Huang P, Li W, Gan B. BAP1 links metabolic regulation of ferroptosis to tumour suppression. Nat Cell Biol. 2018;20:1181-1192. [PubMed] [DOI] |
| 13. | Sun H, Yan J, Tian G, Chen X, Song W. LINC01224 accelerates malignant transformation via MiR-193a-5p/CDK8 axis in gastric cancer. Cancer Med. 2021;10:1377-1393. [PubMed] [DOI] |
| 14. | Chen T, Liu R, Niu Y, Mo H, Wang H, Lu Y, Wang L, Sun L, Wang Y, Tu K, Liu Q. HIF-1α-activated long non-coding RNA KDM4A-AS1 promotes hepatocellular carcinoma progression via the miR-411-5p/KPNA2/AKT pathway. Cell Death Dis. 2021;12:1152. [PubMed] [DOI] |
| 15. | Ren R, Du Y, Niu X, Zang R. ZFPM2-AS1 transcriptionally mediated by STAT1 regulates thyroid cancer cell growth, migration and invasion via miR-515-5p/TUSC3. J Cancer. 2021;12:3393-3406. [PubMed] [DOI] |
| 16. | Xing X, An M, Chen T. LncRNA SNHG20 promotes cell proliferation and invasion by suppressing miR-217 in ovarian cancer. Genes Genomics. 2021;43:1095-1104. [PubMed] [DOI] |
| 17. | Wang P, Lu YQ. Ferroptosis: A Critical Moderator in the Life Cycle of Immune Cells. Front Immunol. 2022;13:877634. [PubMed] [DOI] |
| 18. | Wang W, Green M, Choi JE, Gijón M, Kennedy PD, Johnson JK, Liao P, Lang X, Kryczek I, Sell A, Xia H, Zhou J, Li G, Li J, Li W, Wei S, Vatan L, Zhang H, Szeliga W, Gu W, Liu R, Lawrence TS, Lamb C, Tanno Y, Cieslik M, Stone E, Georgiou G, Chan TA, Chinnaiyan A, Zou W. CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy. Nature. 2019;569:270-274. [PubMed] [DOI] |